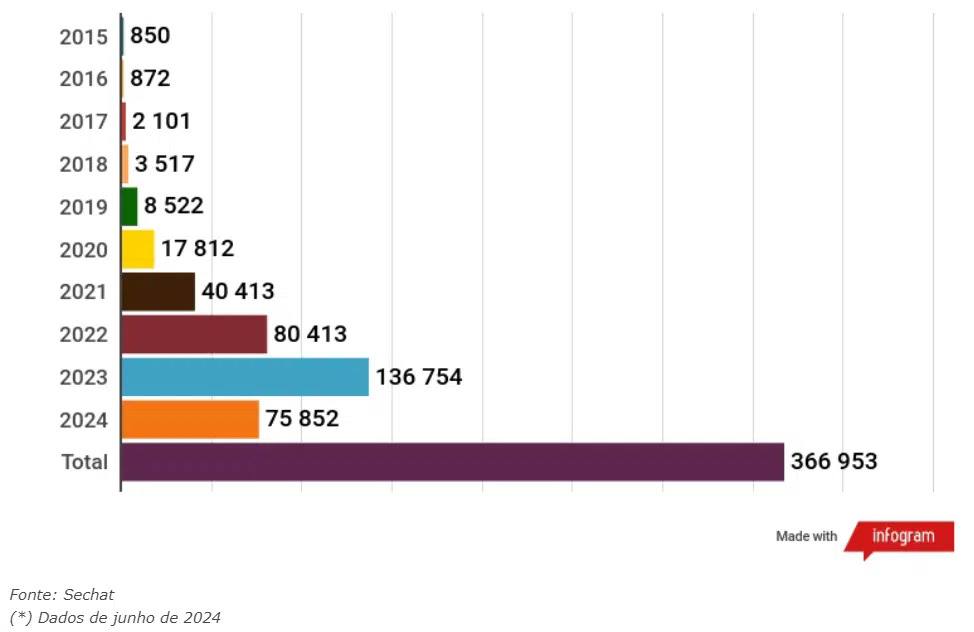
Segundo dados da Anvisa, desde 2015 já foram emitidas 366,9 mil autorizações para importação de canabidiol (CBD) e de outros compostos derivados da cannabis para tratamento médico. O sistema teve início há nove anos por meio da RDC 17. As informações são do portal Sechat.
Em dezembro de 2019, em novo movimento regulatório, a Anvisa publicou a RDC 325 que reclassifica os fitocanabinoides, especialmente o CDB e o THC, na Portaria 344 do Ministério da Saúde. Em 2021, a criação da RDC 570 simplificou a importação individual destes produtos. Inicialmente, o procedimento exigia laudos médicos detalhados e uma análise caso a caso por parte da Anvisa, o que resultava em um processo demorado e complexo.
No entanto, a introdução de sistemas de autorizações automatizadas e a digitalização destes processos, permitiram que os pedidos fossem tratados de forma mais ágil, beneficiando pacientes e médicos. Na sequência, em 2022, surge a RDC 660, que, por meio da união entre a RDC 335/20 e a RDC 570/21, ampliou a gama de profissionais de saúde que poderiam prescrever os medicamentos de cannabis, incluindo dentistas.
Para o neurocirurgião e diretor científico do Sechat, Pedro Pierro, uma das principais vantagens da resolução, além de mais profissionais de saúde prescrevendo os derivados da cannabis, é a diversidade de produtos disponíveis.
“A terapia canabinoide é altamente personalizada, adaptando-se às necessidades específicas de cada paciente. Por isso, a variedade de produtos como óleos, cápsulas, pomadas, sprays, gummies e até supositórios, são essenciais para um tratamento eficaz“, explica.
Fonte: https://panoramafarmaceutico.com.br/autorizacoes-para-importacao-de-canabidiol/



Deixe um comentário